SAE报告流程
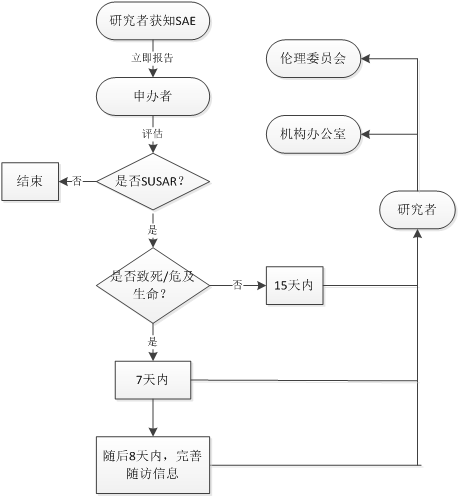
研究者获知SAE后立即(24小时内)书面报告申办者,同步报告机构办公室和伦理委员会。妊娠事件报告按SAE流程报告。
SUSAR报告流程
申办者收到研究者报告的SAE等安全性相关信息后,评估是否为SUSAR。
申办者将确定的SUSAR报告递交研究者签字后,由研究者递交药物临床试验机构办公室和伦理委员会。
致死或者危及生命的SUSAR,申办者应在首次获知后7天内尽快报告,并在随后的8天内报告、完善随访信息(以申办者获知事件当天为0天计算)。非致死或者危及生命的SUSAR,申办者应在首次获知后15天内尽快报告给各部门。
研究者、药物临床试验机构办公室、伦理委员会办公室及时签收申办者提交的SUSAR等安全性资料。
DSUR报告流程
申办者定期汇总DSUR并向我院报告,原则上报告周期不超过一年,报告途径同SUSAR。
报告流程图
注:
严重不良事件(Serious Adverse Event, SAE),是指临床试验过程中发生需住院治疗、延长住院时间、伤残、影响工作能力、危及生命或死亡、导致先天畸形等事件。
可疑且非预期严重不良反应(Suspected Unexpected Serious Adverse Reaction, SUSAR):指临床表现的性质和严重程度超出了试验药物研究者手册、已上市药品的说明书或者产品特性摘要等已有资料信息的可疑并且非预期的严重不良反应。
研发期间安全性更新报告(Development Safety Update Report, DSUR):主要是对报告周期内收集到的与在研药物(无论上市与否)相关的安全性信息进行全面深入的年度回顾和评估。